
グループ紹介
心・血管グループ
研究テーマ
長らく新規の心不全治療薬の承認はありませんでしたが、アンジオテンシン受容体ネプリライシン阻害薬(LCZ696)、洞房結節抑制薬(Ibabradine)が欧米で承認されました。前者の有力な機序はネプリライシン阻害によるANPやBNPといった血中ナトリウムペプチドの上昇による利尿作用であり、後者の有力な機序は脈拍抑制作用でしょう。また、糖尿病治療薬SGLT2阻害薬(エンパグリフロジン)にも心不全抑制作用が報告され、有力な機序として利尿作用が考えられています。しかし、利尿作用や脈拍抑制は以前から考えられていた心不全改善機序でもあり、新たな機序での心不全改善薬が期待されています。
一方、癌の分野では免疫チェックポイント阻害薬としてPD-1抗体やPD-L1抗体が開発され、癌免疫逃避を抑制しT細胞による癌への攻撃を促進させる治療法は悪性黒色腫などで画期的な臨床効果をあげています。また、キメラ抗原受容体を利用した遺伝子組み換えT細胞(CAR-T細胞)は急性リンパ性白血病への寛解誘導が報告されています。しかし、前者の有効率は10-30%であり後者は6-9割に効果があるものの有害事象が強いことが報告されており、引き続き新しい機序の安全で有効な薬剤の開発が期待されています。
我々の開発中の薬剤がこれらの期待に応えられるか現在、研究を続けており基礎研究を社会に還元できる日を夢見ています。
我々のグループのモットーは、昔も今も「論文のための研究に終わらず、あくまで臨床的に役立つ新規治療薬などを開発し病気で苦しむ患者さんに福音となるような成果をめざす」ことです。難治性疾患の新規治療法の開発はとてもハードルが高く、様々な難題と悪戦苦闘していますが、「志あるところに道あり」と信じて突き進んで行きます。牛歩ながらもそのゴールへの道筋はかすかに見えてきたと思っています。
具体的には今のところ、心不全、血管疾患、老化、幹細胞、癌などをターゲットとしています。虚血性心疾患に対してはHGF遺伝子を用いた血管新生療法を確立しました。さらにHGFの抗線維化、抗炎症、抗酸化ストレス、抗老化作用を介した各種病態への保護効果を解析しています。HGF/c-Met systemを介した抗炎症作用が様々な薬剤のpleiotropic effectにどのように関与しているか検討中です。
一方、非虚血性心疾患に対しては接着阻害因子ペリオスチン(PN)の抑制によるリモデリング治療を開発中です(PCT出願中)。さらに、PNが様々な疾患で重要な機能を持つことが明らかとなりつつあり、機能解析及び新規治療法を開発中です。
また動脈硬化の独立した危険因子であるLp(a)の過剰発現マウスを用いて機序の解明を進めています。さらに超音波を用いた遺伝子導入法の開発(PCT出願中)やアフリカツメガエルを用いた心・血管系の発生の研究を進めています。また、臨床的に効果の証明された様々な薬剤のpleiotropic effectの機序を解析中です。さらには、心臓幹細胞など各種臓器に存在しいる幹細胞の機能を解析し、将来的な治療法の開発を考えた研究も開始しました。
元来、循環器内科医師でありながら他科疾患に手を広げるには抵抗もありましたが、対象疾患はそれぞれ違っても分子レベルで考えると驚くほど共通性があります。周囲を包囲することによって直線的には解決できなかった循環器疾患のメカニズムが解明されると信じています。これからも心・血管領域を拠点にしつつも疾患に枠をかけず臨床に役立つ研究を一歩一歩進めていきたいと思います。
我々グループのモットーを理解していただける方で、大阪大学修士や当科所属大学院生を募集中です。それ以外にも他科あるいは他大学所属の大学院生・研究生の長・短期の研究を歓迎します!僕自身がそうでしたが、市中病院で勤務しながら臨床に生かす基礎研究への思いを持っている先生方なども是非参加を検討してください。興味のある方は下記のアドレスに、お気軽にご連絡ください。熱く、楽しく、研究して結果を臨床に還元しましょう。taniyama@cgt.med.osaka-u.ac.jp
1. ぺリオスチン(PNs)を標的とした新規治療法の開発
心不全
心不全期に過剰発現するPN1蛋白がリモデリングを誘導する作用を有しており、その抑制によって心不全のリモデリングを抑制できることを確認しました(Circ. 2004)。さらにAng IIや機械的伸展にて線維芽細胞からPNsが分泌され、ARBにて部分的に抑制できることを確認しています(Hypertens. 2007)。PN1の中和抗体を独自に作成し急性心筋梗塞の翌日から投与し、2か月後に梗塞サイズの縮小化を伴って心機能を著明に改善することを確認しました。(Hypertens. 2016)急性心筋梗塞翌日から、中和抗体を静脈内投与(1回/週x 2)することで慢性期の心不全発生を安全に抑制することができるので、臨床応用に適していると考えています。(PCT承認済み)
我々は独自に昆虫細胞SF-9にバキュロウイルスベクターを用いてヒトPN1-4のスプライシングンバリアントの蛋白質を精製しました。すでにPN2で報告されていた細胞接着作用を線維芽細胞を用いて比較検討したところ陽性コントロールのfibronectin(FN)や陰性コントロールのalbmin(BSA)、無刺激のコントロール(NT)に比してPN1やPN3には細胞接着阻害作用があり、PN2には細胞接着作用があること、PN4は細胞接着も阻害作用もないことを報告しました(Hypertens. 2016)。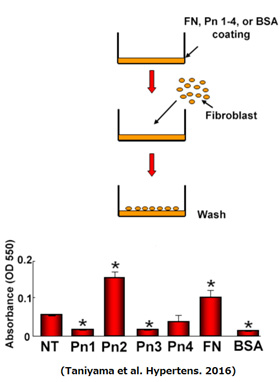 この様にある遺伝子のすべてのスプライシングバリアントの蛋白質の機能を同時に比較した論文は非常に少なく意義が高いと考えています。(右図)。PN2には血管新生作用などの臓器保護効果があり、PN4には心破裂抑制効果がある上に生理的発現が非常に強いためPN2/4を抑制せずに、選択的にPN1/3のみを抑制する我々の中和抗体は合理的でかつ安全と考えられます。また、興味深いことにPN1中和抗体では心筋梗塞後の心筋細胞壊死が著明に抑制されておりました。この機序として足場依存性である心筋細胞の接着を阻害することによって細胞壊死を誘導していることを報告しました(Hypertens. 2016)。PN1中和抗体の亜急性期の投与が、急性心筋梗塞症例の慢性期の心不全発症を防ぐ機序の一旦を解明できたと考えております。責任血管の再疎通の有無にかかわらず急性心筋梗塞後に投与するだけで世界中の急性心筋梗塞患者さんの慢性期の心不全発症抑制が可能であり予後を改善します。さらに、将来の心不全治療にかかるはずたった医療費の削減は各国で膨張する医療費の軽減につながると考えています。一方、心臓でのPNの新しい機能も見出し、そのメカニズムを解析しています。(論文準備中)また、下記に示すようにPNは様々な難治性の慢性炎症性疾患の維持・悪循環に関わっており、これを安全に効果的に抑制することは難病で苦しむ世界中の患者さんにとって有益であると確信しています。下記以外にも重症アトピー性皮膚炎、喘息、特発性間質性肺炎の病態にも深く関わっていることが報告されています。
この様にある遺伝子のすべてのスプライシングバリアントの蛋白質の機能を同時に比較した論文は非常に少なく意義が高いと考えています。(右図)。PN2には血管新生作用などの臓器保護効果があり、PN4には心破裂抑制効果がある上に生理的発現が非常に強いためPN2/4を抑制せずに、選択的にPN1/3のみを抑制する我々の中和抗体は合理的でかつ安全と考えられます。また、興味深いことにPN1中和抗体では心筋梗塞後の心筋細胞壊死が著明に抑制されておりました。この機序として足場依存性である心筋細胞の接着を阻害することによって細胞壊死を誘導していることを報告しました(Hypertens. 2016)。PN1中和抗体の亜急性期の投与が、急性心筋梗塞症例の慢性期の心不全発症を防ぐ機序の一旦を解明できたと考えております。責任血管の再疎通の有無にかかわらず急性心筋梗塞後に投与するだけで世界中の急性心筋梗塞患者さんの慢性期の心不全発症抑制が可能であり予後を改善します。さらに、将来の心不全治療にかかるはずたった医療費の削減は各国で膨張する医療費の軽減につながると考えています。一方、心臓でのPNの新しい機能も見出し、そのメカニズムを解析しています。(論文準備中)また、下記に示すようにPNは様々な難治性の慢性炎症性疾患の維持・悪循環に関わっており、これを安全に効果的に抑制することは難病で苦しむ世界中の患者さんにとって有益であると確信しています。下記以外にも重症アトピー性皮膚炎、喘息、特発性間質性肺炎の病態にも深く関わっていることが報告されています。
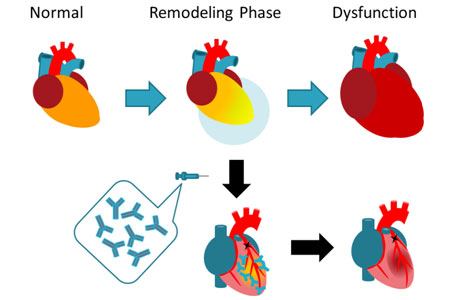
上図に示すように急性心筋梗塞になると、梗塞巣周辺の筋線維芽細胞から過剰発現されるPN1は組織のリモデリングを促進し、慢性期に心不全を発症させます。一方、PN1中和抗体で急性期治療すると慢性期に梗塞サイズを縮小させ心不全の発症を抑制します。心不全の発症抑制は患者さんのQOLや予後を改善するだけでなく、心不全悪化に伴うCCUでの高額な医療や救急チームの多大なマンパワーの消費を抑制することも期待しています。
動脈瘤
我々は様々な動脈瘤のモデルを作成し、その成因を解析することでぺリオスチンが形成過程の血管で過剰発現することを突き止め、PNKOマウスを用いてその作用機序の解析を進めています。昨年のAHAでPNKOマウスではマウスの動脈瘤の形成を有意に改善する作用があることを報告しました。今後もPNと臨床における様々な血管疾患の血管炎症・リモデリングという観点からその作用機序を解明していく予定です。
転移性悪性腫瘍
各種難治性の癌細胞を用いて原発巣の増殖や転移のメカニズムを解析しており、独自の中和抗体を用いて乳癌転移の新規治療法を開発しました(Int J Mol Med 2011)(PCT承認済み)。PNはWntを介して乳癌幹細胞の維持に重要な役割を持ち、PN抑制により乳癌幹細胞の転移が著明に抑制されることが海外からも報告され(Nature. 2011)その重要性が明らかになりました。PNの各々もバリアントがどのような機序で癌の増殖・転移に関わっているかを解析中です。(論文準備中)さらに臨床サンプルを用いた他施設との共同研究から化学療法抵抗性悪性腫瘍との関係を解析しています。(論文準備中)
脳梗塞
PNsは心筋梗塞時の心臓で発現する一方で、PN2を追加投与することによって心筋再生が可能であることが報告され米国で臨床研究が行われています。我々はPN2を脳梗塞マウスモデルに投与し梗塞サイズの縮小作用を持つことを明らかにしました(Stroke 2012)。その機序としてPN2の神経細胞への保護効果を確認しており、PN1にはその保護効果がないことも確認しています。興味深いことに臓器保護の観点からPN2を投与する手法を脳梗塞で、PN1を抑制する手法を心筋梗塞で確認しました。PNのスプライシング・バリアントであるPN1とPN2は基本的には同じ作用があると考えられますが、どのような点で異なるのか解析中です。またPN2の神経幹細胞へ遊走促進作用を解析しています。
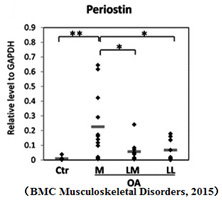 変形性膝関節症(OA)
変形性膝関節症(OA)
大阪大学整形外科教室・椚座先生との共同研究により、臨床での変形性膝関節サンプルを用いてメカニカルストレスによる障害度に応じて軟骨組織やその下の骨組織で分泌されたPN1がNFk-Bを介してIL-6, IL-8やMMP-1/3/13を促進し膝の変形を誘導することを報告しました。(BMC Musculoskeletal Disorders, 2015)ペリオスチンの抑制により膝の変形を抑制できる可能性が示唆されました。
糖尿病性網膜症
九州大学眼科教室との共同研究によって、PN1中和抗体がマウス糖尿病性網膜症モデルの病的血管新生を抑制することを報告しました。(Exp Eye Res. 2016)九州大学眼科教室では、糖尿病性網膜症症例の異常網膜にあり、正常網膜にない遺伝子を網羅的に解析した上で最も異常網膜に偏って共発現している遺伝子がペリオスチンであること、既に治療標的となっているVEGF発現群とペリオスチン発現群が異なることを臨床研究ですでに報告されております(Invest Ophthalmol Vis Sci. 2016)。既存の治療薬で改善できない、あるいは耐性がでてきた症例にPN1中和抗体の投与により改善される可能性が示唆されました。
2. 心・血管・腎・脂肪組織への修復作用
これまでにHGFの血管新生作用(Circ.2001, Gene Ther.2001, Circ. 2004)、抗線維化作用(Circ.2000, Hypertens. 2002)などを報告しました。また、ブタの虚血性心筋症モデルにNOGA systemを用いて経皮経血管的にHGF遺伝子を心臓の虚血部位に遺伝子導入し慢性期に血管新生及び線維化抑制による心機能改善効果を確認しました(Gene Ther. 2006)。さらに、EndMTを介した筋線維芽細胞の抑制作用(Hypertens. 2012 May)・SHIP2のtranslocationを介したEGFRのユビキチン化による抗炎症作用(Circ Res. 2009)・LPSの全身性の炎症に対する防御メカニズム(ATVB. 2012, Inflammation and Regeneration. 2013)・筋線維芽細胞のアノイキスを介した抗線維化作用(J Hypertens. 2010)、PTEN抑制によるAng IIとTGF-bの悪循環の解除を介した抗線維化作用(Hypertens. 2011)・脂肪組織での抗酸化作用、抗炎症作用(Sci Rep. 2017)、PI3K/Akt経路抑制を介したEPCへの抗老化作用(Hypertens. 2009、BBRC. 2012)、脂肪組織リモデリングへの保護効果、アルドステロン誘導による心・腎の酸化ストレスや線維化などへの抑制作用などHGFの様々な障害臓器再生のメカニズムを解明するため遺伝子改変動物を作製し報告しました。(Endoc.& Metab Agents in Med Chem., 2012, Biomedical Report 2013 Inflammation and Regeneration 2013, J Am Heart Assoc. 2013)さらにはマクロファージと脂肪細胞の炎症悪循環をHGFが抑制することを報告し(Hypertens. Res. 2014)、糖代謝へのインスリン抵抗性改善作用も見出しました。(Sci Rep. 2017)。また、臨床の大規模研究でpleiotropic effectの証明された様々な薬剤でのPPARγを介したHGF/c-Met systemの関わりを報告しました(Hypertens. 2012 Feb, Biomedical Report 2013, ATVB. 2016)。現在、HGFの骨格筋への影響を解析しています。一方、血小板・平滑筋細胞のセロトニン受容体(5-HT2A)の拮抗剤が、内皮細胞のセロトニン受容体(5-HT1B)を活性化し高血糖からの血管障害を抑制することを報告しました(Atherosclerosis 2011)。
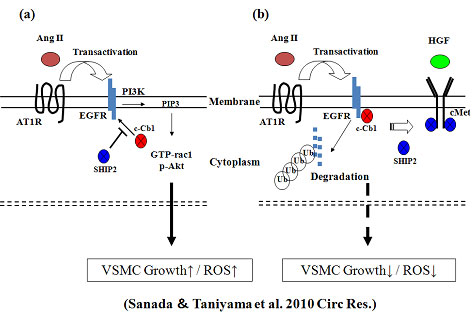
Ang IIのシグナルは上記(a)のように上皮細胞増殖因子受容体(EGFR)を介して増殖や酸化ストレスを引き起こすことが報告されています。一方、(b)にあるようにHGFの受容体c-MetにリガンドであるHGFの刺激が加わると、c-Metは活性化されSHIP2が付くと、EGFRが活性化してもSHIP2がEGFRに付くことができず結果としてユビキチンE3リガーゼCblがEGFRに付き、EGFRが分解されます。HGFのこのEGFR分解を介した抗炎症作用は、EGFRが活性化された時のみに作動し、EGFRが活性化されない平時では作動しません。このようなHGFのユニークな抗炎症作用はreal worldでの炎症を副作用なく抑制する優れたメカニズムであると言えます。また、EGFRはAng II以外にもTNF-aやTGF-b、ET-1、アルドステロン、LPSなど様々な悪性のサイトカインで活性化されるのでHGFはこれらの誘発する酸化ストレスを抑制します。HGFの抗老化作用を伴った血管新生は上記のようなメカニズムによって成立しているのです。
3. Xaの細胞老化を介した血管新生抑制作用
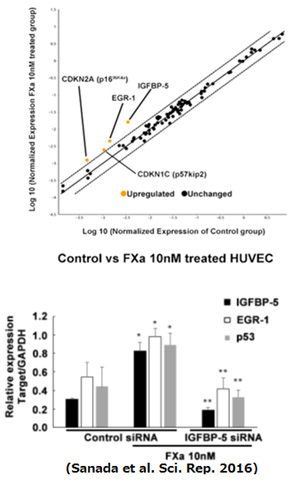 血液凝固因子Xaは心房細動や深部静脈血栓症の血栓形成に深く関与しており、その阻害薬での治療が臨床で行われています。今回、我々はXaが血管内皮細胞の老化を誘導するメカニズムを解明しました。Xaの刺激にて血管内皮細胞が老化する現象を確認した上でマイクロアレイを用いて網羅的にXa刺激にて変化する遺伝子を探索した結果、IGFBP-5やEGR-1、細胞周期抑制に関わるCDKN2A(p16INK4a)やCOKN1C(p57kip2)の発現を確認しました。IGFBP-5がEGR-1の上流であることを確認し、IGFBP-5をsiRNAで抑制したところIGFBP-5、EGR-1、p53が抑制されていました(右図)。さらにXaの内皮細胞のIGFBP-5/EGR-1/p53を介した老化促進を介する血管新生抑制作用がXa阻害剤で抑制されることを報告しました。Xa阻害剤の血管保護効果は今後臨床研究によって証明される可能性があると思います。(Sci Rep. 2016)
血液凝固因子Xaは心房細動や深部静脈血栓症の血栓形成に深く関与しており、その阻害薬での治療が臨床で行われています。今回、我々はXaが血管内皮細胞の老化を誘導するメカニズムを解明しました。Xaの刺激にて血管内皮細胞が老化する現象を確認した上でマイクロアレイを用いて網羅的にXa刺激にて変化する遺伝子を探索した結果、IGFBP-5やEGR-1、細胞周期抑制に関わるCDKN2A(p16INK4a)やCOKN1C(p57kip2)の発現を確認しました。IGFBP-5がEGR-1の上流であることを確認し、IGFBP-5をsiRNAで抑制したところIGFBP-5、EGR-1、p53が抑制されていました(右図)。さらにXaの内皮細胞のIGFBP-5/EGR-1/p53を介した老化促進を介する血管新生抑制作用がXa阻害剤で抑制されることを報告しました。Xa阻害剤の血管保護効果は今後臨床研究によって証明される可能性があると思います。(Sci Rep. 2016)
4. Lipoprotein(a)を介した動脈硬化
Lp(a)はLDLのアポリポ蛋白B-100にアポ蛋白(a)がS-S結合した脂質です。血清Lp(a)高値症例は他のリスクファクターと独立して動脈血栓症を引き起こすと言われています。アポ蛋白(a)は線溶系のプラスミノーゲンと構造が類似しておりプラスミノーゲンと拮抗的に働くと考えられています。抗Lp(a)血症の治療の有効性を示した報告はなく、新規治療法の開発が求められています。我々はヒトLp(a)TGマウスを用いてこのメカニズム・治療法を開発中です。Lp(a)は酸化ストレスを介してEPCの血管新生作用を阻害するのに対して、HGFがこれを抑制し血管新生機能を維持させることを報告しました。(BBRC. 2012) またアンジオテンシン受容体拮抗薬がAT1R非依存的にLp(a)の下流シグナルを抑制する機序について解析中です。
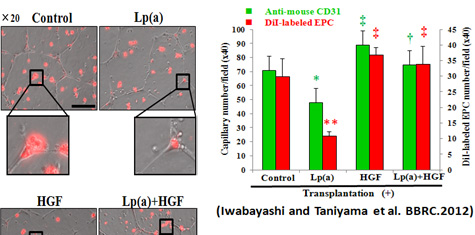
 左図にDiI(赤色)でラベルしたEPCの内皮細胞への培養インコーポレション・アッセイを示します。Lp(a)はROSを介してEPCの血管新生能を抑制しますが、HGFはこれを抑制します。また右図でヒトEPCを各群刺激しDiIでラベルした後にヌードマウスに移植し、下肢虚血モデルを作成した慢性期のEPCとCD31陽性細胞を評価しています。Lp(a)で刺激したEPCの生着(赤)は著明に抑制され、血管新生(緑)も抑制されます。これをHGFで同時に刺激しておくと、この作用がキャンセルされます。このように動脈硬化の危険因子であるLp(a)が誘発する血管障害をHGFが抑制し、生体の恒常性維持に貢献していると考えられます。
左図にDiI(赤色)でラベルしたEPCの内皮細胞への培養インコーポレション・アッセイを示します。Lp(a)はROSを介してEPCの血管新生能を抑制しますが、HGFはこれを抑制します。また右図でヒトEPCを各群刺激しDiIでラベルした後にヌードマウスに移植し、下肢虚血モデルを作成した慢性期のEPCとCD31陽性細胞を評価しています。Lp(a)で刺激したEPCの生着(赤)は著明に抑制され、血管新生(緑)も抑制されます。これをHGFで同時に刺激しておくと、この作用がキャンセルされます。このように動脈硬化の危険因子であるLp(a)が誘発する血管障害をHGFが抑制し、生体の恒常性維持に貢献していると考えられます。
5. 血管・血球系の発生
アフリカツメガエルの卵に血管新生因子を遺伝子導入し、心・血管系の発生期での影響を検討しています。HGFの一次造血への強力な作用(Blood 2004)、VEGFの各isoformによる血球への分化抑制と血管への分化促進作用(BBRC. 2006)、VEGFのHand-1の抑制を介した心臓のチュービング形成障害(BBRC. 2007)、HIF-1αの血管・心臓分化への影響(J Biol Chem. 2008)その他のmoleculeを用いた発生・分化への影響(論文準備中)をES細胞なども用いながら研究しています。
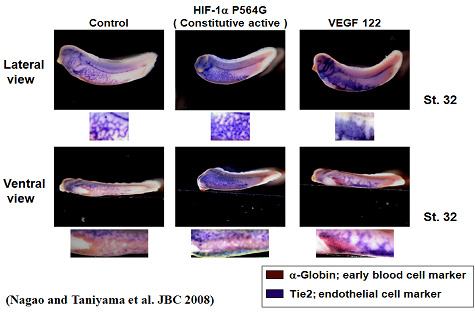
上記はアフリカツメガエルの卵に血管新生因子を導入した後に、血球領域(赤)と血管領域(青)を染色したものです。血管内皮増殖因子VEGFを導入すると右端のように血球領域が小さくなり、逆に血管領域の面積は増えます。しかし、左端のような正常なメッシュ構造は保たれていません。転写因子HIF-1αを導入すると血球領域の減少は少なく、血管領域は増加しますが正常よりさらに細かいメッシュ構造を呈しています。ちなみにHGFでは血管領域の変化はなく、逆に遺伝子発現を抑制すると一次造血機能が減少しました。このように同じように思える血管新生因子も実は、異なる作用を持っているのです。
6. 超音波とマイクロバブルを用いた遺伝子導入法の開発
物理的刺激を用いて安全に遺伝子導入する実験をすすめています。すでに幾つかたくさんの疾患モデルへの応用を発表しています(Circ. 2002, Gene Ther. 2002, Gene Ther. 2004, BBRC. 2004, J.Gene Med. 2005, J Vasc Res. 2005, Gene Ther 2006, JACC. 2009, Current Gene Ther. 2011, Curr Top in Med Chem 2012など)。現在、移植臓器への体外での安全な核酸治療による移植後のレシピエントの急性期拒絶反応を抑制する装置を開発中です(PCT出願中)。
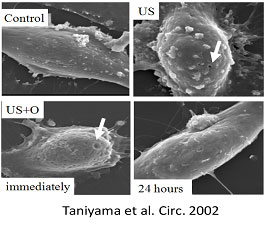 左図に平滑筋細胞の電子顕微鏡の写真を提示します。強い超音波(US)をあてると細胞表面に小孔が発生しますがその後アポトーシスが誘導されます。弱い超音波にマイクロバブルを併用する(US+O)と同様に小孔が発生しますが、24時間後にはその小孔が修復されています。この時に核酸を併用すると核酸が安全に細胞内に導入され安全な遺伝子導入を行うことが可能です。我々はこのように導入効率は高いが安全性に懸念の残るウイルスベクターを用いず、プラスミドDNAを安全に遺伝子導入できる物理的手法の開発を進めています。
左図に平滑筋細胞の電子顕微鏡の写真を提示します。強い超音波(US)をあてると細胞表面に小孔が発生しますがその後アポトーシスが誘導されます。弱い超音波にマイクロバブルを併用する(US+O)と同様に小孔が発生しますが、24時間後にはその小孔が修復されています。この時に核酸を併用すると核酸が安全に細胞内に導入され安全な遺伝子導入を行うことが可能です。我々はこのように導入効率は高いが安全性に懸念の残るウイルスベクターを用いず、プラスミドDNAを安全に遺伝子導入できる物理的手法の開発を進めています。
[心・血管グループ]

